Virushepatitiden gehören heute zu den häufigsten Infektionskrankheiten weltweit. Heute unterscheidet man sechs verschiedene Hepatitisviren: A (HAV), B (HBV), C (HCV), D (HDV), E (HEV) und G (HGV). Dafür, daß in dieser Reihe offensichtlich das F fehlt, gibt es einen Grund. 1994 berichteten Forscher aus Indien über die Entdeckung eines neuen Hepatitisvirus, das sie HFV nannten. Diese Berichte konnten nicht bestätigt werden und so wurde es 1996 auf der Hepatitis-Tagung in Rom zum Artefakt erklärt; in der Zwischenzeit war aber auch das Hepatitis G Virus gefunden worden und so war im Hepatitis-Alphabet eine Lücke entstanden.
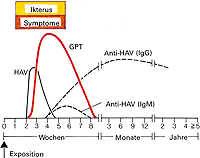
 Abb. 1: Klinik und Labor bei akuter Hepatitis A |
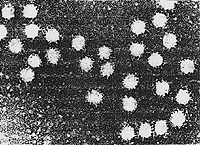 Abb. 2: Elektronenmikroskopische Aufnahme von Hepatitis A Viren |
Das Hepatitis A-Virus (HAV) ist ein RNA-Virus und gehört in die Gruppe der Picornaviren, zu denen auch das Poliovirus, der Erreger der Kinderlähmung, gehört. Es wurde erstmals 1973 nachgewiesen. Im Gegensatz zur Hepatitis B oder C verläuft die Hepatitis A immer akut, es sind allenfalls protrahierte Verläufe (Dauer länger als drei Monate), aber keine chronischen möglich.
Die endemische Verbreitung der Hepatitis A ist sehr unterschiedlich. Während im Mittelmeerraum 80 % der Bevölkerung im Kindesalter unbemerkt eine Hepatitis A überstanden haben, sind bei uns nur 20 - 30 % der Menschen Träger des Antikörpers gegen Hepatitis A (Anti-HAV-IgG). In der Regel geht in Deutschland einer Erkrankungen meist ein Auslandsaufenthalt ("Reisehepatitis") voraus; doch auch in Gemeinschaftsunterkünften wie z.B. Kindergärten und Kasernen kommen kleine Epidemien vor. Die Infektionsquellen sind verunreinigtes Wasser oder Lebensmittel insbesondere bei mangelhaften hygienischen Verhältnissen. Die Viren werden fast ausschließlich durch fäkal-orale Schmierinfektion übertragen. Der sexuelle und parenterale Übertragungsweg ist dagegen selten; dennoch nehmen die HAV-Infektionen bei i.v.-Drogenabhängigen zu. Die Hepatitis A macht in Deutschland etwa 45 % aller akuten Virushepatitiden aus. Abb. 1 und 2
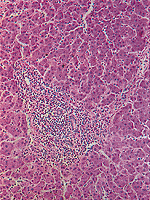
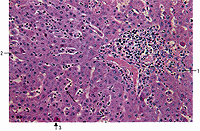 Abb. 3 Histologisches Bild einer akuten Virushepatitis mit 1 lymphozytärer entzündlicher Infiltration der Portafelder und des Parenchyms und und 3 Einzellnekrosen der Leberzellen |
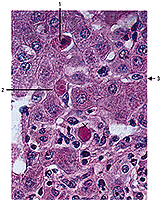 Abb. 4 Histologisches Bild einer akuten Virushepatitis. 1 nekrotische Zelle mit Kernpyknose 2 Councilman-Körperchen 3 vergrößerte Kupffersche Sternzelle |
Bei den Laborwerten sind die Serumtransaminasen AST (SGOT) und ALT (SGPT) vor allem bei Beginn der ikterischen Phase stark erhöht, sowohl das direkte als auch das indirekte Bilirubin sind erhöht, Gerinnungsfaktoren und die Serumcholinesterase können aufgrund der verminderten Lebersyntheseleistung manchmal erniedrigt sein. Das Virus kann bereits im Prodromalstadium im Stuhl gefunden werden. Eine akute Erkrankung läßt sich durch den Nachweis von Anti-HAV-IgM im Serum diagnostizieren. Etwa einen Monat nach einer überstandenen Hepatitis wird der Anti-HAV-IgG-Titer positiv und sorgt für eine lebenslange Immunität. Die Krankheit ist selbstlimitierend und bedarf keiner Therapie. Eine stationäre Aufnahme der Patienten ist nur bei schwerer Allgemeinsymptomatik erforderlich. Es sollten jedoch Bettruhe und ein striktes Alkoholverbot verordnet und hepatotoxische Medikamente abgesetzt werden. Gegen Hepatitis A gibt es sowohl eine aktive als auch eine passive Immunisierung, die für Risikogruppen sowie für Reisen in Endemiegebiete zu empfehlen ist.
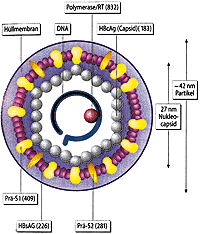 Abb. 5: Schematischer Aufbau des Hepatitis B-Virus |
 Abb. 6: Elektronenmikroskopische Aufnahme von Hepatitis B-Viren |
>
Das 1988 entdeckte Hepatitis E Virus (HEV), das zu den Non A-Non B- (NANB-) Hepatitis Viren gehört, ist ebenfalls ein RNA-Virus und gehört zu den Caliziviren. Außerhalb Europas ist es stark verbreitet, vor allem in Nordafrika, Indien und Zentralamerika.
Im klinischen Verlauf und der Übertragung ist es dem Hepatitis A Virus sehr ähnlich. Auch bei der Hepatitis E zeigen sich nur akute Verläufe, chronische sind nicht bekannt. Allerdings kommt es bei ca. 5 % der Patienten zu einer fulminanten Hepatitis, die innerhalb weniger Tage im Leberzerfallskoma endet, das etwa 90 % der Patienten nicht überleben. Aus unbekannten Gründen ist der Anteil der fulminant verlaufenden Hepatitis E Erkrankungen bei Schwangeren erheblich höher (ca. 20 %). Die Diagnose erfolgt anhand der klinischen Symptomatik und dem Nachweis von Anti-HEV-IgM und Anti-HEV-IgG im Serum. Beide Antikörpertiter fallen nach der Erkrankung rasch ab. Ob Anti-HEV-IgG eine Immunität vermittelt ist noch unsicher. Wie auch bei Hepatitis A gibt es bei Hepatitis E keine kausale Therapie. Bei schweren insbesondere bei fulminanten Verläufen ist also nur eine symptomatische Therapie möglich. Ein Impfstoff existiert momentan noch nicht, an der Entwicklung wird jedoch bereits intensiv gearbeitet.
Das Hepatitis B Virus gehört zu den Hepadnaviren und besitzt als einziges der sechs bisher beschriebenen Viren DNA als Träger der Erbinformation. Das Virus, das bereits 1965 entdeckt wurde, besteht aus folgenden Bestandteilen, die in der serologischen Diagnostik eine Rolle spielen: Einem Oberflächen- oder Surface-Antigen (HBs-Ag), einem Kern- oder Core-Antigen (HBcAg) und einem Protein, das der sekretorischen Form des HBcAg entspricht, dem HbeAg. Gegen diese drei Partikel ist der Körper in der Lage entsprechende Antikörper zu produzieren: Anti-HBs, Anti-HBc und Anti-HBe. Außerdem ist man heute mit Hilfe der PCR in der Lage, auch die HBV-DNA nachzuweisen. Abb. 5 und 6
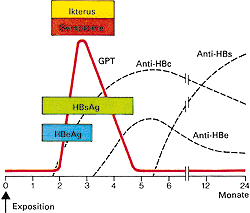 Abb. 7: Klinik und Labor bei akuter symptomatischer Hepatitis B |
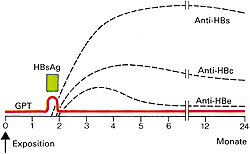 Abb. 8: Klinik und Labor bei akuter asymptomatischer Hepatitis B |
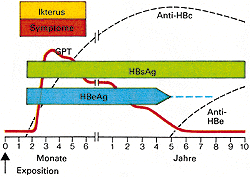 Abb. 9: Klinik u. Labor b. chronischer Hepatitis B |
HBs-Ag ist bei dem größten Teil der Patienten (ca. 90 %) bei Beginn der klinischen Symptome nachweisbar und ist, solange es vorhanden ist ein Anzeichen für bestehende Infektiosität. Der Antikörper Anti-HBc-IgM ist bei akuter Infektion immer nachweisbar. Ein Verschwinden von HBs-Ag und ein Anstieg des Anti-HBs sprechen für einen akuten Verlauf mit beginnender Ausheilung. Den Zeitraum, in dem HBs-Ag nicht mehr und Anti-HBs noch nicht nachweisbar sind, bezeichnet man als diagnostisches Fenster; während dieser Zeit kann eine akute Infektion nur durch Anti-HBc-IgM bestätigt oder ausgeschlossen werden. HBeAg tritt nur gemeinsam mit HBs-Ag auf und ist ein Zeichen für eine vermehrte Virusreplikation. Der zugehörige Antikörper Anti-HBe kann als Zeichen einer verminderten Virusvermehrung und einer geringeren Infektiosität gesehen werden. HBV-DNA ist der Marker für Infektiosität. Patienten, bei denen HBV-DNA mit der empfindlichsten Methode PCR nicht nachgewiesen werden kann, sind nicht infektiös. In 90 % der Fälle kommt es zu einer akuten Hepatitis, die schließlich ausheilt. 25 % der Patienten zeigen dabei Symptome, die einer Hepatitis A sehr ähnlich sind, bei 65 % der Patienten verläuft die Infektion sogar asymptomatisch. In deutlich weniger als einem Prozent der Fälle kann es zu einer letal verlaufenden fulminanten Hepatitis kommen. Abb. 9
Im Gegensatz zu Hepatitis A und E kann eine Infektion mit HBV in etwa 5 -10 % der Fälle chronisch werden. Eine chronische Hepatitis liegt nach Definition dann vor, wenn eine akute Hepatitis nach sechs Monaten nicht ausgeheilt ist. Serologische Hinweise für einen chronischen Verlauf sind das Weiterbestehen von HBs-Ag und HBe-Ag und das Fehlen von Anti-HBs und Anti-HBe. Das Vorhandensein von HBs-Ag im Serum eines Patienten bedeutet jedoch nicht, daß er klinische Symptome zeigt. Im Gegenteil, ca. 80 % der HBs-Ag-Träger sind klinisch gesund. Bei den restlichen 20 % entwickelt sich eine chronisch persistierende Hepatitis (CPH) oder eine chronisch aktive bzw. aggressive Hepatitis (CAH).
Die Übergänge zwischen diesen beiden Formen der chronischen Hepatitis sind oft fließend und die Differentialdiagnose schwierig. Wichtigstes diagnostisches Instrument ist die histologische Beurteilung von Leberbiopsiematerial, das mittels ultraschall- oder CT-gesteuerter Leberblindbiopsie problemlos gewonnen werden kann.
Während für die CAH eine Zerstörung der Läppchenstruktur und sogenannte Mottenfraßnekrosen typisch sind, zeichnet sich die CPH durch eine erhaltene Läppchenstruktur und das Fehlen dieser Nekroseform aus. Aus diesen histologischen Veränderungen läßt sich auch die klinische Symptomatik der beiden chronischen Hepatitis-Formen ableiten. Die CPH verläuft meist asymptomatisch. Manchmal treten Abgeschlagenheit und eine Leistungsminderung auf, die zwar nicht bedrohlich sind, für den Patienten aber sehr belastend sein können. Die Prognose einer CPH ist relativ gut. Nur bei ca. 10 % der Patienten geht die CPH in eine chronisch aggressive Hepatitis über. Bei der CAH kommt es aufgrund der massiven Leberschädigung zu den typischen Lebersymptomen: Druckschmerz im rechten Oberbauch bedingt durch die Lebervergrößerung, Palmarerytheme und Dupuytren'sche Kontrakturen an den Händen, Spider naevi, Regelstörungen bei Frauen, Gynäkomastie und "Bauchglatze" bei Männern. Darüber hinaus kann es bei entzündlichen Schüben der Erkrankung zu einer Bilirubinerhöhung mit Ikterus und Juckreiz kommen.
 Abb. 10: Immunfloureszenzmikroskopische Darstellung des HBs-Antigens in infizierten Leberzellen. |
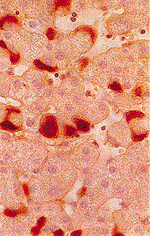 Abb. 11: Immunhistochemischer Nachweis von HBsAg in Leberzellen |
Als Therapie ist bei einer chronischen HBV-Infektion die Behandlung mit Interferon a möglich. Doch nicht alle Patienten sind für diese Behandlungsmethode geeignet. Bei Patienten mit einem supprimierten Immunsystem oder Kindern HBV positiver Mütter, die bei der Geburt infiziert wurden, ist Interferon a wirkungslos. Auch für asymptomatische HBs-Ag-Träger ist dieses Verfahren nicht indiziert. Die Indikationen für die Interferon a-Therapie sind neben den serologischen Zeichen für eine chronische Hepatitis B (HBs-Ag-Träger mit positivem HBeAg) eine nachweisbare Virusreplikation (HBV-DNA positiv) und erhöhte Transaminasen.
Die Behandlung dauert meistens 16 Wochen, bei der die Patienten sich das Interferon a selbst subcutan injizieren können. Bei 10 % der Patienten kommt es zu einem Verlust aller Virusmarker, d.h. auch HBs-Ag wird negativ, was einer Ausheilung gleichzusetzen ist. Bei weiteren 40 % wird eine Serumkonversion beobachtet: Waren vor der Behandlung HBeAg und HBV-DNA nachweisbar, so können nach der Behandlung diese Marker nicht mehr gefunden werden, der Anti-HBe Antikörper wird positiv. Ein Teil der Patienten verliert innerhalb der ersten fünf Jahre nach einer Serokonversion auch das HBs-Ag. Abb. 13, 14, 15 und 16
Eine erfolgreiche Interferon a-Behandlung geht in den meisten Fällen mit einer Erhöhung der Transaminasen - ähnlich einer akuten Virushepatitis - einher. Man nimmt an, daß dieser Effekt auf einer Immunstimulation des zellulären Immunsystems beruht. Zytotoxische T-Zellen zerstören dabei virusbefallene Leberzellen, aus denen die Transaminasen frei werden und im Serum nachgewiesen werden können. Weitere Nebenwirkungen sind unter anderem grippeähnliche Symptome und die Verstärkung von Autoimmun-Prozessen im Körper, die sich aber durch eine Dosisreduktion oder nach dem ein Absetzen von Interferon a zurückbilden.
Die Medikamentengruppe der Nukleosidanaloga stellt eine weitere m&
 Abb. 12: Verlaufsmöglichkeiten einer HBV-Infektion bei gesunden Erwachsenen |
Als letzte Möglichkeit für Patienten mit einer chronischen Hepatitis im Endstadium kann man auch eine Lebertransplantation erwägen. In fast allen Fällen wird die neue Leber jedoch ebenfalls mit HBV infiziert. Da die transplantierte Leber in sehr unterschiedlichem Maße von den Hepatitis B-Viren geschädigt wird, ist eine Aussage über die Prognose bei diesen Patienten fast unmöglich. Beim größten Teil Transplantierter ist der Schaden an der Leber zwar gering, es kann aber auch zu fulminanten Verläufen oder einer schnell progredienten chronischen Hepatitis kommen.
Warum eine HBV-Infektion einen akuten oder chronischen Verlauf nimmt, ist noch nicht vollständig geklärt. Sicher ist, daß die zelluläre Immunität und das Interferon a, das - wie oben erwähnt - bereits gentechnisch hergestellt und in der Therapie eingesetzt wird, dabei eine große Rolle spielen. Zytotoxische T-Zellen sind in der Lage, virusinfizierte Zellen abzutöten und sorgen so für die vollständige Elimination des Virus aus dem Körper. Voraussetzung dafür ist, daß der betroffene Organismus voll immunkompetent ist. So liegt die Viruspersistenz bei nierentransplantierten immunsupprimierten Patienten bei 50 %, während sie bei gesunden Erwachsenen bei nur 10 % liegt.
Interessant ist auch, daß das HBV die Leberzellen selbst nicht schädigt, sondern hierfür ebenfalls immunologische Vorgänge verantwortlich gemacht werden müssen. Ist das Immunsystem nicht in der Lage, das Virus zu eliminieren, kommt es zu einem chronischen Verlauf. Gegen Hepatitis B existiert sowohl eine aktive als auch eine passive Impfung. Die aktive Immunisierung ist allen Risikogruppen zu empfehlen; für Mitarbeiter im medizinischen Bereich ist sie Vorschrift und muß vom Arbeitgeber bezahlt werden. Seit 1995 empfiehlt die ständige Impfkomission, auch Säuglinge, Kinder und Jugendliche gegen Hepatitis B zu impfen.
Das Hepatitis D Virus, das 1977 entdeckt wurde, ist ein defektes RNA-Virus, daß sich nur mit der Hülle von HBV, also mit Hilfe von HBs-Ag vermehren kann. Eine Infektion mit HDV alleine ist deshalb nicht möglich. Immunität gegen Hepatitis B (nach ausgeheilter Erkrankung oder Impfung) vermittelt also auch Immunität gegen HDV. Auch das Vorkommen von HDV ist somit an das Vorhandensein von HBV gebunden. Als Endemiegebiete gelten der Mittelmeerraum, besonders Süditalien, Südamerika und einige Länder Westafrikas. Bei uns ist HDV fast ausschließlich auf die bereits bei HBV erwähnten Risikogruppen beschränkt, da die Übertragung ähnlich dem HBV parenteral und sexuell erfolgt. Auch die Inkubationszeit entspricht der des Hepatitis B Virus mit einem bis sechs Monaten.
Es bestehen zwei Möglichkeiten einer HBV-Infektion. Entweder kommt es zu einer simultanen Infektion mit HBV und HDV oder es findet eine Superinfektion eines HBsAg-Trägers mit HBV statt. Neben Anamnese und Klinik sind folgende serologische Parameter wichtig für die Unterscheidung: Bei der Simultaninfektion sind in der Regel Anti-HDV-IgM und Anti-HDV-IgM positiv, das anfangs positive HBs-Ag wird nach der Ausheilung negativ und Anti-HBs tritt auf. Bei einer Superinfektion kommt es häufig zu einem Verlust von Hbe-Ag und einem Auftreten von Anti-HBe, Anti-HDV-IgM und HBs-Ag sind positiv, Anti-HBc-IgM negativ.
Bei einer Simultaninfektion sind die Prognosen ähnlich wie bei einer solitären HBV-Infektion, d.h. bei 90 % der Patienten kommt es zur Ausheilung, bei 10 % zeigt sich ein chronischer Verlauf. Lediglich der Anteil der fulminanten Verläufe ist bei einer gleichzeitigen Infektion mit HBV und HDV deutlich erhöht und liegt bei etwa 5 %.
 |
 |
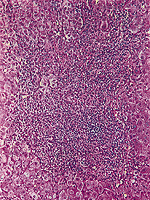 |
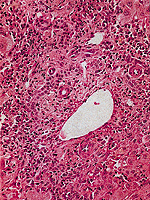 |
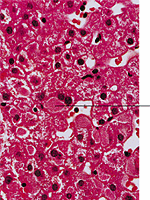
Abb. 13: Histologisches Bild einer chronisch persistierenden Virushepatitis mit entzündlich-lymphozytärer Infiltration des Portalfelde |
Abb. 14: Histologisches Bild einer chronisch persistierenden Virushepatitis mit Milchglaszellen |
Abb. 15: Histologische Bild einer chronisch aggressiven Virushepatitis |
Abb. 16: Histologisches Bild einer chronisch aktiven Virushepatitis mit Zerstörung der Grenzlamelle in der Umgebung des Portalfeldes |
Das Hepatitis C Virus (HCV) wurde 1989 entdeckt. Bereits seit Anfang der 70er Jahre war bekannt, daß die routinemäßige Untersuchung von Blutprodukten auf HBs-Ag zwar die Zahl der Hepatitiden nach Transfusionen reduzierte, es aber weiterhin zu nicht klassifizierbaren Hepatitiden kam. Diesen gab man als Ausschluß-Diagnose den Namen "Non A-Non B-Hepatitiden". Nach der Entdeckung von HCV und der Entwicklung von Screening-Tests, ist die Zahl der Patienten, die nach der Übertragung von Blut oder Blutprodukten eine Hepatitis entwickeln auf beinahe null zurückgegangen. Das HCV enthält als Träger der Erbinformation RNA und gehört zu den Flaviviren. Aufgrund von Nukleotid-Sequenzierungen weiß man, daß mindestens sechs unterschiedliche Genotypen und mehrere Subtypen existieren. HCV ist weltweit verbreitet, allerdings mit unterschiedlicher Verbreitungshäufigkeit der Geno- und Subtypen. 3 % der Weltbevölkerung (ca. 180 Millionen Menschen) sind infiziert. Von den ca. 300.000 Infizierten in Deutschland (ca. 0,4 %) gehören die meisten wegen des überwiegend parenteralen Übertragungsweges einer der folgenden Risikogruppen an: i.v.-Drogenabhängige; Patienten, die Blut oder Blutprodukte erhalten haben und Transplantationspatienten. Auch Mitarbeiter im medizinischen Bereich bilden eine Risikogruppe. Die Gefahr sich beim Geschlechtsverkehr anzustecken ist zwar gegeben, aber geringer als bei HBV. Bei etwa 40 % der HCV-Infizierten ist der Übertragungsweg nicht geklärt.
Die Inkubationszeit liegt zwischen einem und fünf Monaten. Die Diagnosestellung erfolgt auch bei der Hepatitis C nach einer genauen Anamnese (Zugehörigkeit zu einer Risikogruppe?) über serologische Marker: Der Nachweis von HCV-RNA beweist die Infektiosität des Patienten, persistiert bei einem chronischen Verlauf und dient bei quantitativer Bestimmung zur Beurteilung des Therapieerfolges. Anti-HCV wird etwa zwei bis zehn Monate nach der Infektion positiv und persistiert ebenfalls bei einem chronischen Verlauf der Hepatitis C.
Direkt nach einer Infektion mit HCV zeigen die wenigsten Patienten klinische Symptome. Nur etwa 10 % klagen über die bereits oben erwähnten Beschwerden. Doch nur bei ca. 20 % der Patienten ist das Immunsystem in der Lage, das Virus zu eliminieren. Bei 80 % kommt es zu einem chronischen Verlauf, der sich meistens als chronisch aggressive Hepatitis äußert. Als Komplikationen drohen eine Leberzirrhose, die mit einem erhöhten Risiko für ein primäres Leberzellkarzinom einhergeht, und ein Leberversagen.
Deshalb ist es von enormer Bedeutung, möglichst bald nach der Infektion mit einer Interferon a-Therapie zu beginnen. Verschiedene Behandlungsschemata werden im Moment diskutiert. Während in den Vereinigten Staaten eine niedriger dosierte sechsmonatige Therapie favorisiert wird, zeigen Studien aus Europa, daß eine Behandlung über 18 Monate mit einer höheren Dosierung erfolgversprechender ist. Bei nach diesem Schema behandelte Patienten kommt es in 30 % der Fälle zu einer Besserung oder sogar zu einer Ausheilung.
Im Gegensatz zur Hepatitis B, bei der sich ein Therapieerfolg häufig als ein Anstieg der Transaminasen und Symptome einer akuten Hepatitis zeigen, kommt es bei einem Ansprechen auf das Interferon a bei HCV zu einer Abnahme der Transaminasen. Allerdings zeigen sich deutliche Unterschiede in den Therapieerfolgen bei den verschiedenen Typen des HCV. Die ungünstigste Prognose hat der mit ca. 50 % in Deutschland am häufigsten vertretene Subtyp HCV-1b.
Wie bei Hepatitis B wird auch bei HCV der Einsatz von Nukleosidanaloga alleine oder in Kombination mit Interferon a erprobt. Auch die Lebertransplantation bleibt eine Therapieoption bei Patienten mit chronischer Hepatitis C im Endstadium. Die meisten Patienten haben während der ersten Jahre nach einer Transplantation eine deutlich verbesserte Lebensqualität.
Eine Impfung steht im Moment noch nicht zur Verfügung.
Bereits 1995 wurde bei einem Patienten ein Virus entdeckt, das mit den bei Affen vorkommenden Hepatitis Viren GBV-A und GBV-B eng verwandt ist. Es wurde GBV-C genannt. 1996 wurde davon unabhängig von einem Forscherteam ein bis dahin unbekanntes humanes Hepatitis-Virus gefunden. Es wurde Hepatitis G Virus (HGV) genannt und bald stellte sich heraus, daß es mit dem ein Jahr zuvor entdeckten GBV-C genetisch nahezu identisch ist. Die Forscher hatten also unabhängig voneinander das gleiche Virus entdeckt. Deshalb wird die Hepatitis G heute auch manchmal Hepatitis GB genannt. Das Hepatitis G Virus, das RNA als Träger der Erbinformation enthält, gehört wie HCV zur Familie der Flaviviren und steht dem HCV sehr nahe. Da sein Genom aber nur etwa zu einem Viertel mit dem des HCV homolog ist, ist es kein Subtyp dieses Virus. Bis heute sind drei unterschiedliche Typen (A, B und C) des HGV bekannt.
Sicher ist inzwischen, daß das HGV parenteral übertragen werden kann. Der sexuelle Übertragungsweg ist zwar wahrscheinlich, aber bis jetzt noch nicht sicher belegt. Auch für dieses Virus gelten ähnliche Risikogruppen wie für Hepatitis B und C: Vor allem i.v.-Drogenabhängige, Dialysepatienten und Empfänger von Blut oder Blutprodukten sind infiziert. Man nimmt an, daß weltweit etwa 300 Millionen Menschen HGV-Träger sind.
Obwohl der größte Teil der HGV-Infizierten zu chronischen HGV-Trägern wird, verläuft die Erkrankung nach heutigem Wissensstand meist asymptomatisch. Diagnostizieren kann man eine HGV-Infektion durch den Nachweis von HGV-RNA im Serum. Eine Impfung steht nicht zur Verfügung.
Mit der Entdeckung des HGV hat das Hepatitis-Alphabet sicher noch kein Ende gefunden. Es gibt Non-A bis G-Hepatitiden, deren Erreger noch gefunden werden müssen. Die schnellstmögliche Entwicklung von Therapie- und Prophylaxe-Strategien stellt für die Forschung - vor allem angesichts der weltweiten Verbreitung und der großen Zahl von bereits Betroffenen - eine enorme Herausforderung dar.
Literaturverzeichnis
Bildverzeichnis
Anschrift des Verfassers:
Michael Franzen
Am Himbeerschlag 12
80935 München