 |
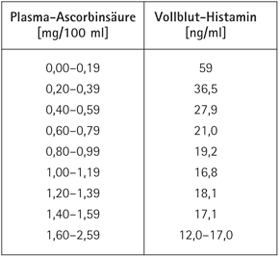
| Abb. 1: Zusammenhang zwischen Plasmaascorbinsäure- und Bluthistaminspiegel. Messung an 437 Humanblutproben (Clemetson 1980) |
Korrelate einer schadstoffinduzierten Veränderung des Histaminstoffwechsels?
Von Jens Bielenberg
Allergien haben in den vergangenen Jahrzehnten stark zugenommen – allerdings nicht weltweit in selben Maße, sondern vor allem in den Industrienationen.
Weit mehr als 20% der Erwachsenen leiden unter allergischen Phänomenen. Zwölf bis 13% sind von einer allergischen Rhinitis, 5% von allergischem Asthma bronchiale betroffen. Dies deutet darauf hin, dass Umwelteinflüsse und Lebensgewohnheiten für die Entstehung von Allergien eine wichtige Rolle spielen. Die Ursachen sind allerdings nicht erforscht. Neuere Theorien sprechen davon, dass unser Hygieneanspruch sich bezüglich der Allergiehäufigkeit negativ auswirkt. Eine weitere Erklärung könnte aber auch eine Störung des Histaminstoffwechsels durch Schadstoffe sein. Der folgende Artikel stellt einige Hypothesen auf der Basis gesicherter Erkenntnisse auf und soll den Dialog eröffnen, um einem der großen medizinischen Probleme unserer Zeit auf die Spur zu kommen.
Die Verbesserung der Hygiene in allen Lebensbereichen ist einer der Gründe, warum sich unsere Lebenserwartung in den letzten hundert Jahren erheblich vergrößert hat. Neuere Studien haben jedoch belegt, dass vor allem zu Beginn des Lebens Umweltfaktoren für die spätere Allergieneigung eine große Rolle spielen. Sterile Wohnverhältnisse scheinen sich negativ auf die Entwicklung bestimmter allergischer Erkrankungen auszuwirken. Eine Untersuchung mit mehr als 1.000 Kindern aus der Schweiz, Süddeutschland und Österreich ergab, dass Kleinkinder, die bereits früh mit endogenen Toxinen in Kontakt kommen, ein geringeres Risiko haben, an einer Allergie zu erkranken, als Kinder die mehr oder weniger steril aufwachsen. Ferner konnte ein Studie mit 2283 Kindern zeigen, dass die Sensibilisierungsrate gegenüber Heuschnupfen und Asthma bei Stadtkindern deutlich höher ist als bei Kindern, die auf einem Bauernhof aufwachsen (10,3% versus 1,3%)(1).
Als Gegenargument erscheint die erhöhte Schadstoffbelastung von Stadtkindern ebenfalls plausible Interpretationsansatze zu liefern. In einer italienischen Untersuchung wurden an 20 Polizisten und Polizistinnen, die ihren Dienst in städtischen Ballungszentren versahen, in den Monaten Dezember und Januar, die Schadstoffbelastung und deren Auswirkung auf den Bronchialtrakt und auf den Vitamin C-Plasma-Spiegel untersucht. Bei den Luftschadstoffen handelte es sich in erster Linie um grobdisperse Stäbe und NO2, deren 24-Stunden-Durchschnittswerte die empfohlenen Grenzwerte für die Luftqualität überschritten. Diese Schadstoffbelastung führte bei asthmatischen und nicht-asthmatischen Probanden zu einer Bronchokonstriktion, die durch vermehrte Histaminfreisetzung und verminderte Freisetzung von vasodilatorischen Prostaglandin E 2 vermittelt wurde. Ferner führten die Luftschadstoffe zu einem geringfügigen aber signifikanten Absinken des Ascorbatspiegels im Plasma. Die bronchokonstriktorischen Effekte konnten mit Vitamin C in hoher Dosierung verhindert oder abgeschwächt werden. Vitamin C beschleunigt den Abbau von Histamin und den Cyclooxygenasemetabolismus von der Synthese des bronchienverengenden PGF 2 zum bronchienerweiternden PGE2 hin verlagert und als Radikalfänger fungiert (2). Unter diesen Aspekten erscheint es sinnvoll, den Histaminstoffwechsel näher zu untersuchen, um in der Histaminfreisetzung und Abbau einen Schlüssel für die Zunahme der Allergien zu finden.
|
Eine Allergie wird im Laufe eines Lebens erworben – oft schon im Kleinkindalter. Die Vererbung kann für die Entstehung einer Allergie immer nur mitverantwortlich sein. Die Krankheit entwickelt sich durch wiederholten Kontakt mit dem allergieauslösenden Stoff. Der sensibilisierte Organismus beginnt nun Eiweißkörper gegen das Allergen zu bilden, sogenannte Immunglobuline. Im Fall des Heuschnupfens spielt das Immunglobulin E (IgE) eine entscheidende Rolle. Das IgE sitzt auf der Oberfläche von Mastzellen. Dringen nun z.B. Blütenpollen über die Nasenschleimhaut in den Organismus ein, kommt es zu einer Reaktion zwischen den Pollen und den auf der Zelloberfläche lokalisierten IgE. Diese Reaktion wirkt als Reiz auf die Mastzelle, Mediatoren auszuschütten, unter anderem das Histamin, das die typischen Heuschnupfensymptome auslöst. Die Mastzellstabilisierung und –degranulation sowie der Histamin-Metabolismus unter dem Aspekt von Umweltschadstoffen soll im Folgenden näher untersucht werden.
Skorbut als Erscheinungsform eines Vitamin-C-Mangels war bereits antiken Ärzten bekannt. Vasco Da Gama verlor auf der Suche nach Indien 100 von 160 Besatzungsmitgliedern an Skorbut. Magellan büßte bei seiner Weltumrundung fünf Schiffsbesatzungen ein und kehrte mit nur 28 Mann zurück. Bis etwa Ende des 18. Jahrhunderts war das Auftreten des Skorbuts bei den Völkern der kälteren Gebiete besonders gegen Ende des Winters und im Frühjahr sehr häufig, da nur Ascorbinsäure-arme Nahrung zur Verfügung stand. Es schlossen sich meist Infektionserkrankungen an und dezimierten mit dem Skorbut die Bevölkerung (5). In der medizinischen Literatur wird über interessante Zusammenhänge zwischen Skorbut und Histaminanstieg im Blut diskutiert. Dabei zeigt sich ein Histaminanstieg lange vor der Manifestierung der klassischen Symptome des Skorbuts, die bei Ascorbinsäurespiegeln im Plasma geringer als 0,2 mg/100 ml auftreten. Der Anstieg des Histaminspiegels beginnt bereits bei Plasmaascorbinsäurespiegeln zwischen 0,8 und 1,0 mg/100 ml und entwickelt sich dann sehr rasch ab 0,7 mmg/100 ml (6). (Abb. 1)
Prof. Dr. Jarisch, Facharzt für Dermatologie und Venerologie, Leiter des Florisdorfer Allergiezentrums Wien, konnte mit allerdings unphysiologisch hohen Konzentrationen Vitamin C, die Plasma-Histamin-Konzentrationen mehr als halbieren. Anhand einer Humanuntersuchung mit Mastocytose-Patienten, d.h. mit Zellen, die eine erhöhte Histamin-Konzentration aufweisen, wollte Prof. Jarisch die Ascorbinsäure-Hypothese belegen. Tatsächlich wiesen die Masocytose-Patienten Vitamin-C-Plasma-Spiegel auf, die nur 50% der Normalbevölkerung entsprechen.
Ein Blick auf die Verstoffwechselung von Histamin liefert einen Ansatzpunkt, dieses Phänomen zu erklären. In der Literatur werden in erster Linie die Acetylierung zum Acetylhistamin,die Oxydation der Seitenkette über eine Diaminoxidase zum Imidazolylacetaldehyd sowie die Methylierung durch die Histaminmethyltransferase beschrieben (7). Bereits 1978 formulierte Subramanian jedoch die Theorie, dass Vitamin C eine Cofaktor von Hydroxylierungsreaktionen ist, die Histamin in die Hydantoinpropionsäure überführen analog dem Histidinabbau in Hydantoinpropionat (8). (Abb. 2)
Abb. 2:
Abbauwege
des Histamins
(mod. n. Forth 1996)
1989 konnten Uchida at all nachweisen, dass Ascorbat in Gegenwart von molekularem Sauerstoff und Cu(2)-Ionen Histamin fast komplett abbauen kann. Diese Reaktion fand an der Imidazol –Gruppe und nicht am primären Amin statt (3).
Histamine werden in den Granula der Mastzellen gespeichert in einer Konzentration von 3x10-1 mol/l. Nach Freisetzung erfolgt eine rasche Umverteilung in den extrazellulären Raum und Metabolisierung, da die Histamin-Konzentration auf 10-4 mol/l absinkt. Ascorbinsäure hat einen mastzellstabilisierenden Effekt, der entweder auf einer Hemmung der Phosphodiesterase oder aus der Aktivierung des Katecholaminstoffwechsels beruht (9). Bereits 1804 beobachtete Reisseissen Symptome eines bei Patienten mit Skorbut „konvulsiven Asthmas“. Die Beteiligung von Katecholaminen am Vitamin-C-Effekt konnte in einer Versuchsreihe an Meerschweinchen, die ebenso wie der Mensch kein Vitamin synthetisieren können, belegt werden. So konnte die Gabe von 500 mg Vitamin C die Histamin-induzierte Bronchokonstriktion aufheben. Dieser Effekt wurde durch Propranolol antagonisiert (10). Die Tatsache, dass Ascorbinsäure ferner den Serotonin- und Bradykinin-Effekt antagonisieren konnte, belegt die Assoziation, dass Vitamin C nicht direkt an der glatten Muskulatur antagonistisch wirkt, sondern über die Stabilisierung der Mastzellmembran. Bei einem Kollektiv von 16 Patienten mit allergischer Rhinitis konnte doppeltblind ein Effekt von 2 g Vitamin C auf die Empfindlichkeit der Atemwege auf Histamin nach Inhalation nachgewiesen werden (2).
Neben dem oxydativen Histaminabbau zum Hydantoin, der jedoch nur eine untergeordnete Rolle zu spielen scheint, stellt die Methylierung des Imidazolstickstoffs einen Hauptabbauweg des Histamin dar. Hauptmethylgruppendonator für heterocyclische Stickstoffatome ist Adenosylmethionin, deren Konzentration in entscheidender Weise von der Aktivität der Adenosylmethioninsynthase abhängt. Glutathion ist ein Modulator der Aktivität dieses Enzyms (11). Glutathion besitzt ferner reduzierende Eigenschaften für Dehydroascorbinsäure und vermag die oxydierte Vitamin-C-Form in einem nicht enzymatischen Prozess spontan zu „recyclen“, d. h. in einem Zustand oxydativen Stresses dient Glutathion nicht nur für die Entgiftung und Eliminierung von Radikalen, sondern es regeneriert Vitamin C für denselben Zweck (12). Ein Absinken des Quotienten von reduziertem zu oxydiertem Glutathion hemmt die Aktivität der Adenosylmethioninsynthase und senkt den Pool von übertragbaren Methylgruppen, z. B. auf den Imidazolstickstoff des Histamins. Interessant ist in diesem Zusammenhang, dass Adenosylmethionin Donator einer Aminopropyl-Gruppe ist, die das Diamin Putrescin, ein 1,4-Diaminobutan in das Spermidin überführt (13). Diamine gelten als Histaminliberatoren. Hui und Mitarbeiter konnten nachweisen, dass die gleichzeitige Gabe von Diaminen Cadaverin und Putrescin sowie Aminoguanidin, Isoniazid, Tyramin und beta-Phenylethylamin mit (C14)-Histaminen zu einem erhöhten Spiegel an unmetabolisierten Histamin und vermindertem Wirkspiegel von Histaminmetaboliten führen (4). Daraus lässt sich die Fragestellung ableiten:
Für die mitochondrialen Cytochrom-P450-Isoenzyme der Cytochrom-II-Familie galt bisher eine strikte Substratspezifität für die Biosynthese von Steroiden. 1995 konnte zum ersten Mal am pharmakologischen und toxikologischen Institut des Biomedizinischen Zentrums in Uppsala nachgewiesen werden, dass der adrenotoxische Umweltschadstoff 3-Methylsulfonyl –2,2? bis (4-chlorophenyl) 1,1 dichloroethen über das Cytochrom P450-CII-Isoenzym metabolisiert wird, so dass nach Aussage der Verfasser der Interaktion zwischen Xenobiotika und der Glucocorticoidsynthese in Zukunft mehr Aufmerksamkeit geschenkt werden sollte (14).
Frage: Können Umweltschadstoffe durch Interaktion mit der Biosynthese von Glukocorticoiden die Mastzellfunktion verändern?
Mastzellen repräsentieren eine heterogene Zellpopulation, die in unterschiedlichen Geweben vorkommt, wie im Gesicht, den unteren und oberen Atemwegen, im Gastrointestinaltrakt sowie auf anderen Schleimhäuten. Es wurde das Konzept entwickelt, dass Mastzellen durch Induktion entzündlicher Prozesse Abwehrmechanismen stimulieren, wenn toxische Agentien die Mucosa des Organismus durchschritten haben. Die Aktivierung pulmonaler Mastzellen durch IgE-abhängige Prozesse führt zu einer Freisetzung von Entzündungsmediatoren wie Histamin, Prostaglandinen und Cysteinyl-Leukotrienen, die Kontraktionen der glatten Muskulatur verursachen, die Schleimproduktion und die Gefäßpermeabilität erhöhen. Der Effekt von Glucocorticoiden auf Mastzellen scheint nicht auf einer Hemmung der IgE-abhängigen Freisetzung von Histamin und Mastzellen zu beruhen, was die Inkubation von menschlichen Lungenmastzellen mit physiologischen Konzentrationen von Glucocorticoiden belegt, sondern bei Patienten mit allergischer Rhinitis konnte eine Abnahme der saisonal induzierten Zunahme der nasalen Mucosamastzellen durch Glucocorticoide beobachtet werden. Ferner konnte die Antigen-induzierte Mediatorfreisetzung aus den Mastzellen gehemmt werden (15). Es stellt sich daher die Frage, ob eine Hemmung der physiologischen Glucocorticoidbiosynthese durch Aktivitätsabnahme von Cytochromen innerhalb einer Hypoascorbose die Mastzellkonzentration in der Bronchialmucosa und die Empfindlichkeit auf Antigene erhöht.
Abb. 3:
Bindungsstärke bzw. Verdrängungskapazität einiger Chemiekalien für die T4-Bindungsstelle am Transthyretin.
(Quelle: Van den Berg, K.J. et al.; Arcj. Toxikol. (1991) 65: 15-19 Thyroxine (T4))
Das wichtigste Substrat der Diaminoxidase ist Histamin. Die Amin-Oxidasen haben die Funktion, die biologisch oft hochwirksamen biogenen Amine zu inaktivieren. Hierzu werden die Amine zu den entsprechenden Iminen dehydriert. Die Diaminoxidase wandelt das Histamin zum Imidazolylacetaldehyd um. Die Aminoxidasen sind Flavoproteinoxidasen, d.h. sie sind riboflavin-abhängig. Verschiedene Grunderkrankungen können einen Riboflavin-Mangel begünstigen. Bei einer Schilddrüsenüberfunktion ist die Riboflavinresorption vermindert, die Flavokinaseaktivität erhöht, bei einer Schilddrüsenunterfunktion ist die Resorption von Riboflavin erhöht, die Flavolkinaseaktivität aber erniedrigt. Die Flavokinasen wandeln Riboflavin in die katalytisch aktiven FMN und FAD um. Daraus folgt, dass Funktionsstörungen der Schilddrüse den Histaminabbau beeinflussen können. Viele Umweltschadstoffe können die Schilddrüsenfunktion verändern. Van den Berg und Mitarbeiter vom Medical Biological Laboratory, Rijswijk, Niederlande, konnten ca. 40 Substanzen aus 12 verschiedenen Stoffklassen nachweisen, die über einen kompetitiven Mechanismus die Bindung von T4 an das Transportprotein Transthyretin hemmen. Dies gilt besonders für Chlorphenole, Chlorphenoxysäuren und Nitrophenole (Abb. 3) (16). Auch die Desinfektionsmittel Chlor, Monochloramin und Chlordioxyd im Trinkwasser wirken nach verschiedenen Untersuchungen strumigen. In Arealen mit vielen Baumschulen in Südschleswig-Holstein mussten zahlreiche Brunnen geschlossen werden, weil die Kontamination des Trinkwassers mit aliphatischen Chlorverbindungen aus Pestiziden zu hoch war. Damit schließt sich hier der Kreis. Wie eingangs in diesem Artikel bereits dargestellt, postulieren verschiedene Wissenschaftler, dass sterile Wohnverhältnisse eher das Auftreten von Allergien fördern. Die Autoren führen dies auf eine fehlende mikrobielle Exposition zurück. Es stellt sich aber auch die Frage, ob Funktionsstörungen der Schilddrüse infolge vermehrter Belastung mit Chlorverbindungen den Histaminstoffwechsel verändern?
Der vierte Abbauweg des Histamins erfolgt über eine Acetylierung. Dieser Abbauweg erscheint aber eine untergeordnete Rolle zu spielen. Hui konnte bei Ratten mithilfe radioaktiv markierten Histamins nachweisen, dass ca. 10 % der Gesamtdosis Histamin über die Faeces ausgeschieden wird. Die Analyse des 4-Stunden–Urins ergab, dass Imidazolylessigsäure (60,6 %-Diaminoxidase) der Hauptmetabolit war, gefolgt von N-Methylimidazolessigsäure (8,69%-Metyltransferase), N-Methylhistamin (7,6%-Methyltransferase) und N-Acetylhistamin (4,5%).
Die Acetylierung erfolgt über N-Acetyltransferase.
Abschließend sollte auch die Frage gestellt werden, ob genetische Polymorphismen in der Expression der Acetyltransferasen eine individuelle Prädisposition zur Entwicklung einer Allergie verursachen.
Vielleicht können diese Fragen einen Impuls geben, dem Problem zunehmender Allergien auf die Spur zu kommen.
Quellen:
1) Wichmann, H.E.: Ein wenig Dreck schadet nicht, Allergieprävention. Fortbildungskongress der Apothekerkammer BRD, 4.10.2002 in Mallorca, Deutsche Apothekerzeitung, 142 (41); 4977:2002
2) Bucca,C; Farina,JC.: Rolla G: Vitamin C und Bronchoreaktivität, Vitaminspur 7, 80-89: 1992
3) Uchida, K;Mitsui, M.: Kawakishi,S: Monooxygenation of N-Acetylhistamine mediated by ascorbate. Biochim. biophys Acta. 991(2), 377-9:1989
4) Hui, JY;Taylor, SL.: Inhibition of in vivo histamine metabolismn in rats by footborne and pharmacologic inhibitors of diamineoxidase, histamin N-Methyltransfrase, and monoaminooxidase. Toxiocol Appl Pharmacol 81(2),241-9:1985
5) Stone, I.: The healing factor Vitamin C against disease, Grosset and Dunlap, New York (1977)
6) Clementson, CAB: Nutrition 110,662 :1980
7) Forth, W.: Allgemeine und spezielle Pharmakologie und Toxikologie, 7. Auflage, Heidelberg 321:1996
8) Karlson: Lehrbuch der Biochemie, Georg Thieme-Verlag, S. 158
9) Bayer, W; Schmidt, KH.: Vitamine in Prävention und Therapie, Stuttgart (1991)
10) Zuskin, E; et al: Inhibition of histamine-induced airway constriction by ascorbic acid, J. Allergy Clin. Immun. 51,218-26 (1973)
11) Pajares, M; et al: Modulation of Rat Liver S-Adenosylmethionine Synthetase Activity by Glutathione, The J of Biological Biochemie. 267,17598-17605 :1992
12) Bigley, R; Riddle, M; Layman, D.: Biochim. Biophys. Acta. 659,15 :1981
13) Chiang, PK; et al: S-Adenosylmethionine and methylation, The Faseb-Journal. 10,471-80:1996
14) Lund, BO; Lund J.: Novel involvement of a mitochondrial steroidhydroxylase (P450 CII) in xenobiotic metabolism. Biol. Chem. 270/36, 20895-897:1995
15) Taylor, IK; Shaw, RJ.: The mechanism of action of corticosteroids in asthma, Respiratory medicine. 87,216-77 (1993)
16) van den Berg, KJ.: Arch.Toxicol 65,15-19 :1991
Anschrift des Verfassers:
Jens Bielenberg
Apotheker, Raphael-Apotheke
25364 Westerhorn
Bahnhofstr. 53
PDF-Datei (für Abonnenten der Naturheilpraxis)
Zum Inhaltsverzeichnis
Naturheilpraxis 04/2010