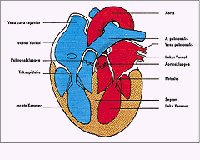
Abb. 1: Herzvorhöfe und -kammern, Herzklappen und große Gefäße.
Das Kreislaufsystem des Menschen besteht aus dem Herz als zentrale Pumpe, den Gefäßen des Körperkreislaufs (= Systemkreislauf) und dem Lungenkreislauf (= kleiner Kreislauf).
Das Herz liegt im unteren vorderen Brustkorb, etwas links von der Mittellinie. Die sogenannte Herzachse verläuft von rechts-oben-hinten nach links-unten-vorne. Das menschliche Herz besitzt nicht die typische "Herzform", sondern ist ein eher kegelförmiger Muskelschlauch, der sich rhythmisch zusammenzieht und dabei seinen Inhalt auspreßt. Diese Bewegung ist nur dann effizient, wenn das Blut nicht auf beiden Seilen ausspritzen kann, so dass ein regelmäßiger Blutstrom gewährleistet ist. Deswegen befinden sich im Herzen eingebaute Ventile, die Herzklappen.
Beim Erwachsenen ist das Herz in zwei vollständig getrennte Seiten, die linke und die rechte Hälfte, aufgeteilt. Jede dieser Hälften ist wiederum in Vorhof und Kammer (= Ventrikel) getrennt. Die Kammern besitzen zwei Klappen an jedem Ende; die eine, um bei der Kontraktion den Rückstrom in die zuführenden Gefäße (Venen) zu verhindern, die andere, damit das Blut nach der Erschlaffung aus den abführenden Gefäßen (Arterien) nicht wieder in die Kammer zurückläuft.
Zur schnelleren Füllung der Kammern sind die Vorhöfe als "Sammelbecken" vorgeschaltet. In den rechten Vorhof münden die großen Venen des Körperkreislaufs, in den linken Vorhof die der Lunge. Die Klappen zwischen Vorhöfen und Kammern, die sog. Segelklappen, erlauben eine Blutbewegung in Richtung der Kammern. Das rechte Herz pumpt das Blut über die Lungenarterie (= Pulmonalarterie) in den kleinen Kreislauf; das linke Herz ist über die Hauptschlagader (= Aorta) für den Körperkreislauf zuständig. Die Klappen an den Herzausgängen, die Taschenklappen, sind so konzipiert, dass sie den Rückstrom des ausgeworfenen Blutes verhindern. Alle Klappen liegen in einer Ebene, der Ventilebene. (Abb. 1 + 2)

Abb. 1: Herzvorhöfe und -kammern, Herzklappen und große Gefäße. |

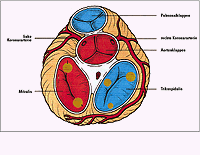
Abb. 2: Herzklappen (Ventilebene) und Koronarien. |
|
Den eigentlichen Motor des Blutkreislaufs stellt die dicke Muskelwand der Kammern, das Myokard, dar. Die Herzgröße ist abhängig vom Gewicht und vom Füllungszustand. Allgemein gilt die "Faustregel", die besagt, dass die Größe des Herzens in etwa der Faust seines Trägers entspricht. Das normale Gewicht beträgt 300 - 500 g; ab 500 g spricht man vom sogenannten kritischen Herzgewicht, das aber z.B. bei intensivem Ausdauertraining (Sportlerherz) durchaus noch normal sein kann. Entsprechend seiner schweren und ständig andauernden Arbeit muss das Herz gut mit Sauerstoff und Nährstoffen versorgt werden. Zuständig dafür sind die Herzkranzgefäße, die Koronarien. Es gibt eine rechte und eine linke Kranzarterie, die kurz oberhalb der Aortenklappe als erste Äste von der Hauptschlagader abgehen und entsprechend ihrer weiteren Aufteilung verschiedene Areale des Herzen versorgen. Ausgekleidet wird das Herz von der Herzinnenhaut, dem Endokard; es überzieht die Kammern, die Vorhöfe und die Klappen.
An der Außenseite befindet sich das Perikardium, der Herzbeutel. Es besteht aus einem inneren Blatt, dem Epikard, das dem Herzmuskel direkt aufliegt und einem äußeren Blatt, dem Perikard. Somit ist der Herzbeutel eine Gleitschicht für die ständige Bewegung des Herzens.
Im Gegensatz zu den Muskelfasern des Skelettsystems, die nur durch Befehle aus dem zentralen Nervensystem erregt werden können, sind die spezifischen Herzmuskelzellen im Stande selbständig Erregungen zu bilden und fortzuleiten. Einflüsse aus dem vegetativen Nervensystem wirken nur modulierend.
Die Erregungsbildung geht vom Schrittmacher des Herzens, dem Sinusknoten, einem Geflecht aus Herzmuskelfasern in der Wand des rechten Vorhofs, aus. Über die Vorhofmuskulatur erreicht die Erregung den Atrioventrikular (AV)-Knoten am Boden des rechten Vorhofs. Entlang weiterer Strukturen, dem Hisschen Bündel und den Purkinje-Fasern, wird die gesamte Kammermuskulatur erreicht und die Kontraktion ausgelöst. In Ruhe gehen vom Sinusknoten 60-70 mal pro Minute Impulse aus, was der normalen Herzfrequenz entspricht. Fällt der Sinusknoten aus, können theoretisch alle Strukturen des Erregungsleitungssystems die Schrittmacherfunktion übernehmen, dann aber mit niedrigerer Frequenz.
Bei der Herztätigkeit unterscheidet man zwei Zyklen:
1. die Kontraktionsphase = Systole
2. die Erschlaffungsphase = Diastole
Zu Beginn der Systole kommt es zu einem Druckanstieg im linken Ventrikel; übersteigt dieser den des linken Vorhofs, schließen sich die Segelklappen. In der folgenden Anspannungsphase steigt der Druck weiter, bis er höher wird als der in der Aorta und sich die Taschenklappen öffnen. Man spricht von der Austreibungsphase der Systole. wobei das Blut auf hohe Geschwindigkeit beschleunigt wird. Etwa nach der Hälfte der Austreibungsphase lässt die Kontraktionskraft des Herzmuskels nach und der Druck in der linken Kammer fällt wieder ab; ist die Geschwindigkeit des Blutes nicht mehr ausreichend, kommt es zur Umkehr der Stromrichtung und die Taschenklappen schlagen, gemäß ihrer Funktion als Einwegventile, zu. Ähnlich verhält es sich mit der Systole des rechten Ventrikels.
Nach dem Schluss der Taschenklappen beginnt mit der Erschlaffungsphase die Diastole. Der Innendruck der Kammern fällt, bis sich ab ca. 5 mmHg die Segelklappen öffnen und die Füllungsphase, die in der Regel länger dauert als die Austreibungsphase, beginnt.
Erste wichtige Informationen liefert die Anamnese, wobei eventuelle Risikofaktoren für Herzerkrankungen, wie familiäre Vorbelastung, koronare Risikofaktoren (Bluthochdruck, Rauchen, Diabetes mellitus, Übergewicht), Alkoholabusus, frühere Infekte, Brustschmerzen etc. abgeklärt werden sollten.
Die körperliche Untersuchung beinhaltet Inspektion, Perkussion, Palpation, Auskultation und Messung des Blutdrucks.
Eine der wichtigsten Diagnosemöglichkeiten bietet das EKG. Durch die Aufzeichnung von Erregungsbildung und -rückbildung kann es wesentliche Informationen über eventuelle Störungen der Herzfunktion geben. Auch die bildgebenden Verfahren spielen bei der Herzdiagnostik eine große Rolle:
Mit Hilfe der Thorax (= Brustkorb) Röntgenuntersuchung können Größe und Form des Herzens mit eventuellen Abweichungen beurteilt werden.
Durch die spezielle röntgenologische Technik der CT (Computertomographie) kann ein Querschnitt von Herz und den großen Gefäßen entworfen werden.
Die Echokardiographie erlaubt ohne Strahlenbelastung des Patienten die Erfassung der Pumpfunktion, krankhafter Veränderungen und Herzfehlern.
Die neueste Methode der Diagnostik ist die Kernspintomographie, die auf dem Aufbau des Gewebebildes durch die Drehbewegung von Wasserstoffatomen im Körpergewebe basiert.
Die genaue Bestimmung der Druckverhältnisse erfolgt hauptsächlich über invasive Methoden, wie den Herzkatheter.
Da das Herz ein sehr anpassungsfähiges Organ ist, verändert es seine Form und Größe entsprechend der jeweiligen Beanspruchung.
a) Hypertrophie und Dilatation
Unter einer Herzhypertrophie versteht man die Zunahme der Muskelmasse, die mit einer Gewichtsvermehrung einhergeht. Allerdings ist davon nicht das gesamte Herz betroffen, sondern nur diejenigen Teile, die den veränderten Belastungen ausgesetzt sind.
Von der sogenannten konzentrischen Hypertrophie spricht man, wenn die Wand der Kammern verdickt, der Innenraum verengt, das Herz aber insgesamt nicht vergrößert ist.
Die konzentrische Hypertrophie ist Folge eines pulmonalen Hochdrucks, der durch Erkrankungen der Lunge oder angeborene Herz- oder Herzklappenfehler hervorgerufen werden kann. Man spricht dann vom Cor pulmonale; charakteristisch ist eine deutliche Zunahme des Herzgewichts auf bis zu 800 g (Cor bovinum). Eine Linksherz-Hypertrophie entwickelt sich bei Hypertonie (= Hochdruck) im großen Kreislauf; wobei nicht die Ursache, sondern das Ausmaß der Hypertonie entscheidend ist. Weitere Gründe einer Hypertrophie des linken Herzens können eine Stenose (= Einengung) der Aortenklappe oder des Anfangsteils der Aorta sein. (Abb. 3 + 4)
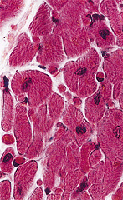
Abb. 3: Normaler Herzmuskel im Querschnitt |
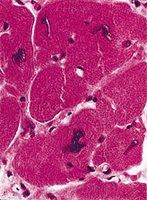
Abb. 4: Hypertrophe Herzmuskelzellen |
Liegt eine erhöhte Volumenbelastung vor, z.B. bei Insuffizienz (= Schlussunfähigkeit) von Herzklappen, beobachtet man eine exzentrische Hypertrophie. Hierbei ist der Herzinnenraum kaum verengt, sondern die Zunahme an Muskelmasse äußert sich in einer Vergrößerung des Organs; typisch ist dabei die Abrundung der Herzspitze: man spricht vom Übergang der "gotischen" in die "romanische" Herzspitzenform.
Die Hypertrophie hat ihr optimales Ausmaß erreicht, wenn die Zunahme an Muskelmasse die erhöhte Beanspruchung ausgleichen kann. Ein Problem stellt allerdings die Blutversorgung dar, die ab dem kritischen Herzgewicht von 500 g nicht mehr uneingeschränkt gewährleistet ist. Sofern keine Schäden an der Muskulatur entstanden sind, bildet sich die Hypertrophie nach Ende der erhöhten Belastung relativ schnell zurück. Bei der Herzdilatation, einer krankhaften Ausweitung des Herzens bzw. seiner Innenräume, dominieren stark erweiterte Höhlen mit gleichzeitig nur geringer Wandhypertrophie und Gewichtszunahme. Sie kann durch Insuffizienzen oder plötzlich erhöhte Druck/Volumenbelastungen (z.B. bei einer Lungenembolie), aber auch durch Schädigung der Herzmuskelzellen mit Tonusverlust entstehen.
b) Herzatrophie
Bei einem Herzgewicht von weniger als 250 g spricht man von einer Herzatrophie.
Zugrunde liegt eine allgemeine Verkleinerung der Herzmuskelfasern, die auch nur herzförmig begrenzt auftreten kann, z.B. nach lokaler Schädigung bei Herzinfarkt. Durch die Atrophie der einzelnen Fasern steigt die Konzentration des Farbstoffes Lipofuszin, so dass das atrophierte Herz durch seine braune Farbe auffällt. Als normal wird die Atrophie angesehen, wenn sie altersbedingt ist; man spricht dann von Involution. Sie kann auch die Folge einer starken körperlichen Gewichtsabnahme sein, wobei es zum Schwund des subepikardialen Fettgewebes kommt. Die Koronargefäße zeigen dann einen geschlängelten Verlauf und das Schlagvolumen wird deutlich geringer. (Abb. 5 + 6)
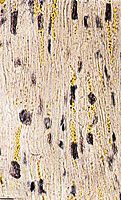
Abb.5: Herzmuskelatrophie; Lipofuszineinlagerungen |
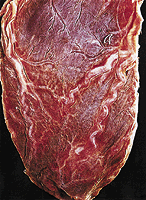
Abb. 6: Herzatrophie; Schwund des subepikardialen Fettgewebes und geschlängelte Koronararterien |
Die Herzinsuffizienz ist definiert als Unvermögen des Herzens, dem Organismus trotz genügenden venösen Angebots ein ausreichendes Blutvolumen für seine Stoffwechselleistungen zur Verfügung zu stellen. Diese Minderung der Förderleistung wirkt sich auf fast alle Organsysteme aus und zeigt sich klinisch durch kardiale Symptome und Störungen anderer Organe, z.B. aufgrund verminderter Durchblutung oder Überfüllung der Venen oder der Lungenstrombahn.
Die Ursachen der Herzinsuffizienz sind vielfältiger Natur. Am häufigsten ist sie Ursache einer exzessiven Druck- und Volumenbelastung. Des weiteren beobachtet man Herzinsuffzienzen bei Behinderungen der Füllung der linken Kammer, bei Störungen der Sauerstoffversorgung und bei Pumpschwächen infolge von Herzmuskelerkrankungen, die eine Einschränkung der Kontraktilität und Dehnbarkeit des Herzens hervorrufen.
Der Körper reagiert mit einer Reihe von Kompensationsmechanismen: Man beobachtet eine Stimulation des sympatho-adrenalen Systems mit einer Konstriktion der Widerstandsgefäße, Steigerung der Herztätigkeit und verminderter Wasserausscheidung, die eine Erhöhung des Volumens in den Gefäßen mit sich bringt. Obwohl diese Mechanismen eigentlich als Kompensation gedacht sind, verstärken sie noch die Symptome der Herzinsuffizienz (erhöhter Druck und Volumen!) und es entsteht ein Circulus vitiosus, der medikamentös unterbrochen werden muss.
Nach Vorgabe der NYHA (New York Heart Association) wird die Herzinsuffizienz nach der Belastbarkeit in vier Schweregrade eingeteilt: NYHA I (hohe Belastbarkeit ohne Beschwerden) bis NYHA IV (Beschwerden bereits in Ruhe, keine Belastung mehr möglich).
Aufgrund der mangelnden Kreislaufleistung klagen die Patienten über Schwindel, schnelle Ermüdbarkeit, deutliche Einschränkung der körperlichen Belastbarkeit und Atemnot (= Dyspnoe). Außerdem beobachtet man Kältegefühl, Schmerzen im Oberbauch und häufiges Wasserlassen während der Nacht (= Nykturie).
Liegt eine Einschränkung der Pumpleistung des linken Ventrikels vor, spricht man von einer Linksherzinsuffizienz, die sich in einer Stauung des Lungenkreislaufs - im schlimmsten Fall als Lungenödem - äußert. Dabei kommt es zu einem Austritt von Flüssigkeit in die Lungenbläschen (= Alveolen), was zu einer Störung der Gasverteilung, des Gasaustausches und einer verminderten Dehnbarkeit der Lunge führt. Im akuten Stadium dieser Stauung haben die Patienten starke Atemnot, eine verlängerte Ausatmungsphase, Schweißausbrüche, Herzrasen und eventuell einen schaumig-blutigen Auswurf.
Bei der Auskultation der Lunge dominieren feuchte Rasselgeräusche und Pfeiftöne bei der Ausatmung. Weitere wichtige Anzeichen einer Linksherzinsuffizienz sind nächtliches Asthma cardiale und eine Orthopnoe, was bedeutet, dass die Patienten mit hochgelagertem Oberkörper schlafen. Dadurch erreichen sie ein Absacken der Stauung in der Lunge, so dass die oberen Areale besser belüftet und die Atemnot gelindert wird.
Aus der Verminderung der Kapazität des rechten Herzens ergeben sich Stauungen vor dem Herzen, also in den Venenstämmen, im Bauchraum und in den Unterschenkeln. Die Stauungen im Abdomen führen zu Leber- und Milzvergrößerung sowie Funktionsstörungen der Bauchorgane.
Ursächlich für die Rechtsherzinsuffizienz sind angeborene und erworbene Klappenfehler und Hypertension der Lunge: nur selten ist die Rechtsherzinsuffizienz auf Herzmuskelerkrankungen zurückzuführen, da diese vornehmlich die linke Kammer betreffen.
Eine spezielle Form der Rechtsherzinsuffizienz ist das sogenannte Cor pulmonale. Dabei entsteht die Überlastung der rechten Kammer durch Erkrankungen der Lunge.
Akut tritt das Cor pulmonale nach einer plötzlichen Verlegung der Lungenstrombahn auf, wie z.B. nach einer Lungenembolie oder einem akuten Asthmaanfall. Die Patienten verspüren extreme Atemnot und der Blutdruck kann bis zum Schock abfallen. Bei ca. einem Drittel der Patienten entsteht nach einer Lungenembolie ein Lungeninfarkt, vor allem wenn durch den Embolus kleine Lungenarterien in der Peripherie verschlossen wurden.
Klinische Symptome sind Fieber, Husten mit blutigem Auswurf Schmerzen im Brustbereich und ein Anstieg der Entzündungsparameter im Blutbild. Wegen der hohen Letalitätsrate ist eine sofortige Therapie mit Blutgerinnungshemmern, Thrombolyse und eventuell eine Entfernung des Thrombus, z.B. mittels Saugkatheter, notwendig.
Das chronische Cor pulmonale entwickelt sich auf der Grundlage chronischer Lungenerkrankungen (Fibrosen, Emphyseme) oder bei Lungengefäßerkrankungen.
Meist findet man bei den Betroffenen gestaute Halsvenen und Wasseransammlungen (= Ödeme) in den Beinen. Weitere häufige Symptome sind Druckgefühle in der Lebergegend, Blähungen, Brustschmerzen, Atemnot, Müdigkeit und kurzzeitige Bewußtseinsstörungen. Im Gegensatz zur Linksherzinsuffizienz zeigen die Patienten keine Orthopnoe, da ja die Stauung nicht in der Lunge, sondern vor dem rechten Herzen besteht.
Laut der Definition der WHO von 1980 handelt es sich bei den Kardiomyopathien um Erkrankungen, die primär das Herz betreffen, denen aber kein Bluthochdruck, keine koronare Herzkrankheit, kein Klappenfehler und keine Lungenerkrankung zugrunde liegt.
Herzmuskelerkrankungen, deren Entstehung noch ungeklärt ist, werden unter dem Begriff primäre Kardiomyopathien zusammengefasst. Man teilt sie heute in drei große Gruppen ein: die dilatative, die hypertrophe und die restriktive Kardiomyopathie.
a) dilatative Kardiomyopathie:
Im Vordergrund steht eine hochgradige Erweiterung beider Herzkammern. Die Ursachen sind vielfältig, meist aber auf einen durch Viren ausgelösten Autoimmunprozess zurückzuführen. Oft ist die dilatative Kardiomyopathie Folge einer Myokarditis (= Herzmuskelentzündung) aufgrund einer Grippevirusinfektion, die allerdings kaum klinische Erscheinungen zeigt.
Gefährlicher ist eine Myokarditis bei Diphtherie, die bei schweren Verlaufsformen beinahe immer auftritt. Auch bei Scharlach und Tuberkulose ist die Entwicklung einer Myokarditis nicht selten.
Weitere Infektionskrankheiten wie Typhus, Salmonellose, Ruhr, Keuchhusten oder Kinderlähmung können durchaus eine Entzündung des Herzmuskels mit sich bringen: der Krankheitsverlauf ist dann allerdings häufig klinisch unauffällig und heilt unbemerkt aus.
Die Symptome der dilatativen Kardiomyopathien sind unabhängig von den zugrunde liegenden Ursachen sehr ähnlich. Die Patienten klagen über Schmerzen und Beklemmungsgefühle im Brustbereich, Atemnot und Schwindel. Schwere Fälle können mit Herzinsuffizienz einhergehen.
b) hypertrophe Kardiomyopathien:
Auch ihre Entstehung ist noch ungeklärt, doch wurde eine gewisse familiäre Häufung beobachtet. Bereits im frühen Erwachsenenalter kommt es zu einem konzentrischen, überschießenden Wachstum der Herzmuskelzellen, was vor allem zu einer Einengung des linken Ventrikels führt. Aufgrund dieser Einengung ist sowohl die Füllung als auch die Entleerung behindert.
Zu den klinischen Symptomen zählen unter anderem Herzrhythmusstörungen, Benommenheit, Schwindel und Atemnot.
c) restriktive Kardiomyopathien:
Sie umfassen mehrere Krankheitsbilder, die sich nicht immer exakt voneinander abgrenzen lassen. Charakteristisch ist eine stark eingeschränkte Ventrikelfunktion, eine deutliche Verdickung des Herzmuskel, wobei die Innenräume aber nur leicht dilatiert sind.
Neben verschiedenartigen krankhaften Einlagerungen in das Herzgewebe ist das sogenannte hypereosinophile Syndrom (tropische Endokardfibrose, Endokarditis parietalis fibroplastica) ursächlich für eine restriktive Kardiomyopathie. Dabei findet man eine krankhafte Verdickung des Endokards, die auch auf die Klappen übergreifen und ihre Funktionstüchtigkeit einschränken kann.
Von sekundären Kardiomyopathien spricht man, wenn die Krankheit durch Einwirken von Giften oder Speicherung bestimmter Substanzen auf dem Boden einer Stoffwechselstörung entsteht.
a) Verfettung:

Bei Sauerstoffmangel, z.B. nach CO-Vergiftung, starkem Blutverlust oder bei chronischer Anämie, kommt es zu einer fettigen Degeneration der Muskelzellen. Diese verfetteten Muskelfaserabschnitte wechseln sich rhythmisch mit unveränderten Fasern ab, so dass makroskopisch eine "Tigerung" des Herzens auffällt. (Abb. 7)
b) Davon streng abzugrenzen ist das Fettherz (Lipomatosis cordis).
Es ist Ausdruck eines allgemeinen Übergewichts mit kardialer Manifestation. Bei der Durchsetzung des Herzmuskels werden hier Bindegewebs- in Fettzellen umgewandelt. In schweren Fällen reicht das Fett bis ans Endokard und kann sich in alten Infarktnarben sammeln. Bei extrem hohem Übergewicht spricht man vom sog. "Pickwickian-Syndrom" (vgl. Charles Dickens: Pickwickier; "Fatty Joe") mit Zwerchfellhochstand, Hypoventilation und Cor pulmonale: häufigste Todesursache ist eine Lungenembolie. (Abb. 8)
c) Amyloidose:
Amyloid bedeutet "stärkeähnlich". Es handelt sich um ein extrazellulär abgelagertes Glykoprotein. Diese Ablagerungen verursachen einen zunehmenden Druck auf benachbarte Zellen und Blutgefäße wodurch es zu Permeabilitätsstörungen der betroffenen Organe kommt.

Ursachen einer Amyloidose sind Entzündungsreaktionen (generalisierte A.) oder Tumore innerer Drüsen, z. B. Schilddrüsenkarzinom (lokalisierte A.). Das Amyloid kann diffus zwischen den Fasern oder um Gefäße lokalisiert sein: häufig ist das Erregungsleitungssystem betroffen, was Herzrhythmusstörungen hervorruft. Ansonsten führen selbst ausgeprägte Ablagerungen kaum zu Störungen der Herzfunktion.
d) Glykogenspeicherkrankheit:
Bei der Glykogenose T II (Morbus Pompe) kommt es zu einer abnormen Speicherung von Glykogen in den Zellen, der ein angeborener Enzymdefekt zugrunde liegt. Klinisch manifestiert sich diese Erkrankung in fortschreitender Herzinsuffizienz.
e) Kardiomyopathien bei Elektrolytstörungen:
Sowohl ein Mangel (Hypo) als auch ein Überschuss (Hyper) an Kalium führen zu Schädigungen des Herzmuskels.
Bei der Hyperkaliämie (durch Infusion, Niereninsuffizienz) treten Rhythmusstörungen, verlangsamter Herzschlag und eventuell sogar Herzstillstand auf.
Die größere klinische Bedeutung kommt der Hypokaliämie (starke Durchfälle, Erbrechen, Entwässerungsmittel) zu. Einzelne Zellen sterben ab und es kommt zu einer Wassereinlagerung zwischen den Zellen, die zur Auflösung der kleinen Fasereinheiten führt.
f) Alkohol-Kardiomyopathien:
Beim chronischen Alkoholabusus kann die Kardiomyopathie auf eine Mangelernährung oder auf die direkte toxische Wirkung des Alkohols auf den Zellstoffwechsel zurückgeführt werden. Bei extremem Eiweißmangel beobachtet man ein allgemeines Einschmelzen der Muskulatur, somit auch der des Herzens. Die Folge sind Rhythmusstörungen und Insuffizienzen; bei weitergeführtem Abusus beträgt die 10-Jahres-Sterblichkeit 50 %.
Bei der Myokarditis handelt es sich um eine Entzündung des Herzmuskels.
Makroskopisch entspricht das Bild dem eines Infarkts, mikroskopisch lassen sich Entzündungszellen nachweisen. Wie bereits erwähnt hat eine Myokarditis oft eine dilatative Kardiomyopathie zur Folge, es können aber auch Insuffizienzen und Rhythmusstörungen, wenn das Erregungsleitungssystem von der Entzündung betroffen ist, ausbilden.
Die Patienten sind blass, unruhig und haben ein Engegefühl in der Brust. Der Puls ist relativ schwach und der Blutdruck in der Regel niedrig. In seltenen Fällen kann es zu Kammerflimmern kommen. Die Ursachen einer Myokarditis sind sehr vielfältig: dabei kann es sich um eine entzündliche Mitreaktion bei Stoffwechsel- und Skeletterkrankungen oder ein metastatisches, eitriges, Infekt- oder arzneimittelallergisches Geschehen handeln.
Eigenständigen Myokarditiden liegt häufig eine Bakterien-, Viren-, Pilzinfektion oder Parasitenbefall zugrunde. Die rheumatische Myokarditis ist immunologisch bedingt, hervorgerufen durch das rheumatische Fieber, das sich nach einer Infektion mit Streptokokken Gruppe A entwickelt. Im mikroskopischen Bild fallen die sog. Aschoff-Knötchen, typische Granulome aus einer Nekrose des Bindegewebes, auf.
Die Endokarditis stellt eine Entzündung der Herzinnenwand dar; meist tritt sie als Endokarditis der Klappen auf (= E. valvularis), doch können auch Bereiche der Vorhöfe und Kammern betroffen sein. In der Mehrzahl der Fälle sind die Klappen des linken Herzens befallen, wobei man zwischen verschiedenen Formen der Endokarditiden unterscheidet:
a) bei der verruköse Endokarditis zeigen sich rötliche, leicht abwischbare Auflagerungen aus Fibrin und Thrombozyten.
b) die ulzeröse Endokarditis fällt durch ihre ausgedehnte Zerstörung des Klappengerüstes auf. Sie begrifft hauptsächlich die Aortenklappe.
c) bei der Endokarditis polyposa findet man auf den Klappenoberflächen thrombotisches Material und Bakterienansammlungen. Oft kommt es auch hier zu Zerstörungen der Grundstrukturen.
d) den vernarbten Zustand einer früheren Endokarditis bezeichnet man als Endokarditis fibroplastica. Die veränderten Klappen sind in der Regel insuffizient (ungenügende Schließung) oder stenotisch (eingeschränkte Beweglichkeit wegen Verwachsungen der Klappenränder).
Eine weitere Differenzierung erfolgt in Hinsicht auf die verschiedenen Auslöser der Entzündung:
a) bakterielle Endokarditis:
Die bakterielle Endokarditis, auch E. lenta genannt, wird vor allem durch Streptococcus viridans, einem normalen Keim der Mundflora, verursacht. Bei Zahnbehandlungen kann dieser Erreger über den Blutweg ins Herz gelangen und siedelt sich dort vorwiegend auf schon geschädigten Klappen ab.
Typische Symptome sind anfängliches ungeklärtes Fieber, Anämie, zunehmende Herzinsuffizienz und ein langsamer, schubweiser Verlauf.
b) akute bakterielle Endokarditis:
Für die akute bakterielle Endokarditis sind Erreger mit hoher Virulenz, wie z.B. Pneumokokken oder Gonokokken, verantwortlich. Sie können auch an gesunden Klappen zu erheblichen Zerstörungen führen. Der dramatische Verlauf ist gekennzeichnet durch Fieber, Schüttelfrost, Bewusstseinstrübungen und massive Herzinsuffizienz.
c) abakterielle Endokarditis:
Sie kann eine Erscheinung des rheumatischen Fiebers sein; bei der Diagnose ist dabei auf extrakardiale Begleiterscheinungen wie Gelenk-, Nieren- und Bauchsymptome sowie Hautveränderungen zu achten. Weitere Ursachen können eine Kachexie (E. marantica), der Lupus erythematodes (Libman-Sachs-E.) oder metastasierende Karzinoide sein.
Mit angeborenen Herzfehlern (Vitien) meint man eine von Geburt an makroskopisch sichtbare, anormale Struktur des Herzens. Die Gesamthäufigkeit angeborener Vitien beträgt 8-10 pro 1000 Lebendgeburten, wobei viele Defekte leicht sind und spontan ausheilen. Sie sind teilweise genetisch vorbestimmt und werden durch äußere Einflüsse in ihrer Realisierung beeinflusst. Dazu zählen Rötelembryopathien, Sauerstoffmangel, Diabetes und Alkoholabusus der Mutter. Oft sind Vitien auch gehäuft bei bestimmten Erkrankungen oder als Bestandteil von Syndromen zu beobachten (Stoffwechselstörungen, Trisomie 21, Turner-Syndrom). Klinisch bedeutsam ist vor allem eine Unterscheidung zwischen Herzfehlern mit oder ohne Verbindung (Shunt) von großem und kleinem Kreislauf.
a) primäre Links-Rechts-Shunts:
1. Ventrikelseptumdefekt:
Er stellt die häufigste angeborene Mißbildung dar. Kleinere Defekte schließen sich oft spontan während der ersten Lebensjahre oder die Menge des Shuntblutes ist so gering, dass nicht in die Hämodynamik des Herzens eingegriffen wird. Die Patienten scheinen gesund, haben keine Beschwerden und sowohl EKG als auch der Röntgenbefund sind normal. (Abb. 9)
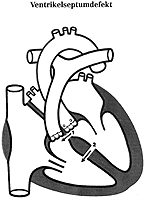
Bei großen Defekten treten allerdings recht früh Symptome wie Atemnot oder Leistungsabfall in Erscheinung. Durch den großen Links-Rechts-Shunt wirkt sich der hohe Druck im linken Ventrikel direkt auf den Lungenkreislauf aus. Daraus resultiert ein zunehmender Wandumbau der Lungengefäße, was zu einem erhöhten Widerstand und schließlich zur Shuntumkehr führt (Eisenmenger-Reaktion). Man beobachtet eine allgemeine Zyanose (Blaufärbung), später kommt es zu Thromboseneigung und Trommelschlegelfingern.
2. Vorhofseptumdefekt:
Während der Embryonalzeit besteht noch eine Verbindung zwischen den beiden Vorhöfen, die sich nach der Geburt spontan verschließt. Kommt dieser Verschluss nicht zustande, spricht man von einem Vorhofseptumdefekt.
Das klinische Bild wird von der Größe des Vitiums bestimmt. Die auffallend grazilen Patienten sind bei kleineren Defekten relativ normal belastbar. Nur sehr große Vitien haben bereits im Säuglingsalter eine Herzinsuffizienz (Trinkschwäche, Kurzatmigkeit) zur Folge. Mit zunehmendem Alter treten Ermüdbarkeit und gehäufte broncho-pulmonale Infekte hinzu. Zeigt sich eine zentrale Zyanose und Trommelschlegelfinger, hat eine Shunt-Umkehr stattgefunden. Ohne Operation beträgt die Lebenserwartung nur ca. 40 Jahre. Die Betroffenen sterben meist an Herzhythmusstörungen oder Herzinsuffizienz.
3. Offener Ductus Botalli:
Der Ductus Botalli leitet während der Embryonalzeit das venöse Blut unter Umgehung der noch nicht funktionstüchtigen Lungen direkt in die Aorta. Normalerweise verschließt er sich spontan während der ersten Lebensmonate, falls nicht, spricht man vom Ductus Botalli apertus. (Abb. 10)
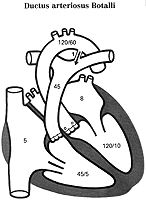
Da der Druck in der Aorta nach der Geburt etwa viermal so hoch ist wie in der Lungenarterie, kehrt sich die Strömungsrichtung um und arterielles Blut fließt in die Lungenarterie zurück, wodurch es zu einer erhöhten Volumenbelastung des linken Herzens kommt. Die Lunge ist vermehrt durchblutet und entwickelt mit der Zeit eine Pulmonalstenose. Der Widerstand steigt, bis eine zur Shunt-Umkehr erfolgt. Somit gelangt venöses Blut in den Körperkreislauf und bewirkt eine Zyanose der unteren Körperhälfte (obere Hälfte gut versorgt, da die Mündung des Ductus Botalli unterhalb der Abgänge der Kopf- und Armarterien liegt). Charakteristischer Befund der Auskultation ist ein "Maschinengeräusch" und ein schneller, hoher Puls (pulsus celer et altus).
b) primäre Rechts-Links-Shunts
1. Truncus arteriosus communis persistens:
Bei diesem Vitium entspringt aus dem Herzen nur eine gemeinsame Schlagader für den Lungen- und den Körperkreislauf aus der auch die Koronarien und die Arterien für die obere Körperhälfte abgehen. Ursache ist ein fehlendes Septum zwischen Aorta und Pulmonalis und ein gleichzeitiger Ventrikelseptumdefekt. Somit führt das Gefäß ständig Mischblut und man beobachtet eine dauerhafte Zyanose. (Abb. 11)
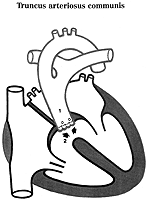
2. Fallot-Tetralogie:
Bei der Fallot-Tetralogie handelt es sich um eine Kombination aus Pulmonalstenose, Ventrikelseptumdefekt mit darüber "reitender" Aorta und Hypertrophie des rechten Ventrikels. Sie ist die häufigste Missbildung mit Zyanose nach dem ersten Lebensjahr (Verschluss des Ductus Botalli).
Wegen der Pulmonalstenose gelangt über den Septumdefekt venöses Blut in die linke Kammer und verursacht eine allgemeine Zyanose, die vor allem an den Lippen, Schleimhäuten und an den Ohren auffällt. Es kommt zu Trommelschlegelfinger und Uhrglasnägel; Muskulatur und Fettgewebe sind nur mäßig entwickelt. Typisch ist die Hockstellung bei Kindern, die hilft, die Lungendurchblutung zu verbessern. Falls kein chirurgischer Eingriff erfolgt liegt die durchschnittliche Lebenserwartung nur bei etwa 12-20 Jahren.
Sie können einzeln, aber auch im Gefolge von anderen Missbildungen auftreten.
a) Pulmonalstenose:
Bei der valvulären Pulmonalstenose beobachtet man eine Einengung der Klappen und eine Erweiterung des Gefäßes nach der Stenose. Durch den erhöhten Druck in der rechten Kammer kommt es dort zur Hypertrophie.
b) Aortenstenose:
Sie macht circa 70 % der linksventrikulären Stenosen aus und ist hauptsächlich bei Männern zu finden. Es kommt zu erhöhter Druckbelastung und Hypertrophie des linken Herzens.
a) Mitralstenose:
Sie ist der häufigste erworbene Klappenfehler und entsteht meist auf der Grundlage des rheumatischen Fiebers oder einer bakteriellen Endokarditis. Durch die behinderte Öffnung der Mitralklappe entsteht im linken Vorhof ein hoher Druck, der schließlich zum Rückstau in die Lunge führt.
Die Patienten klagen über Atemnot bei Belastung und schlafen mit hochgelagertem Oberkörper (Orthopnoe). Alarmierende Symptome sind Lungenödeme und blutiger Auswurf Typisch sind außerdem die sogenannten "Mitralbäckchen", bläulich-rote Flecken auf beiden Wangen und gestaute Halsvenen.
Als Komplikationen treten Vorhofflimmern, Thrombenbildung, Embolien und Lungeninfarkte auf. Leichte Stenosen bedürfen keiner Therapie; bei ausgeprägteren Formen ist eine Aufdehnung der Stenose oder sogar ein Klappenersatz notwendig.
b) Mitralinsuffizienz:
Bei der Mitralinsuffizienz können sowohl Defekte der Klappen (z.B. nach bakterieller Endokarditis) als auch des Halteapparats (Sehnenfäden, Papillarmuskel) ursächlich sein.
Eine akute Insuffizienz (Riss eines Sehnenfadens) kann zu plötzlicher Herzinsuffizienz führen, während sich der chronische Verlauf oft über Jahrzehnte hinzieht.
Wegen des defekten Verschlussmechanismus fließt das Blut in den linken Vorhof zurück und verursacht dort ein Volumenüberangebot mit Dilatation. Im Gegensatz zur Mitralstenose haben die Betroffenen keine Atemnot, sondern verstärktes Herzklopfen; auch die "Mitralbäckchen" fehlen.
Die Prognose einer Mitralinsuffizienz ist recht gut, vor allem, wenn schwere Belastungen vermieden werden und nicht eine Koronarstenose, die Kraft des Herzens allgemein vermindert, erschwerend hinzukommt.
3. Mitralklappenprolaps:
Er ist eine Sonderform der Mitralinsuffizienz, bei der sich die Segel der Klappe während der Systole in den Vorhof wölben. Die meisten Betroffenen sind beschwerdefrei, doch können gelegentlich leichte Ermüdbarkeit, schneller Puls und zentral-nervöse Ausfälle beobachtet werden.
Erkrankungen der Herzkranzgefäße stellen die häufigsten und wohl auch bekanntesten Herzkrankheiten dar.
Unter einem Herzinfarkt (= ischämische Herzkrankheit) versteht man den umschriebenen Untergang von Herzmuskelgewebe aufgrund eines Missverhältnisses zwischen Sauerstoffbedarf und -angebot. In beinahe allen Fällen ist die Mangeldurchblutung auf eine krankhafte Veränderung der Koronarien zurückzuführen. Der Auslöser ist oft eine plötzliche körperliche oder psychische Belastung mit Durchblutungsnot oder ein Blutdruckabfall, so dass die ohnehin verengten Gefäße nur noch mangelhaft durchströmt werden. Dies erklärt, warum Infarkte häufig nach Operationen mit großem Blutverlust oder nachts, wenn der Blutdruck absinkt, auftreten.
In der Mehrzahl der Fälle ist der linke Ventrikel betroffen: Infarkte der rechten Kammer sind sehr selten. Mit 50 % der ischämischen Herzkrankheiten ist der Vorderwandinfarkt der häufigste Lokalisationsort; gefolgt vom Hinterwandinfarkt mit 30 %. Auch die Ausdehnung eines Infarktareals kann beträchtlich schwanken. Der Zirkumferenzinfarkt umfasst die gesamte linke Hinterwand; beim transmuralen Infarkt sind alle Wandschichten einbezogen und die Gefahr eines sofortigen Todes ist am höchsten.
Makroskopisch ist ein Infarkt erst ca. 8 Stunden nach dem Ereignis sichtbar. Man beobachtet eine lehmfarbene, feste Nekrose, deren Umfang von der Größe des Ischämiegebietes abhängt. Nach etwa einer Woche wird die Nekrose durch Granulationsgewebe abgebaut, Kapillaren sprossen ein und nach sechs bis acht Wochen ist eine bindegewebige, derbe, weißliche Narbe entstanden.
Das klinische Bild verläuft in vielen Fällen recht charakteristisch. Die Betroffenen haben plötzlich einsetzende, heftige, lang andauernde Brustschmerzen, die in einen Arm, den Rücken, den Oberbauch oder in den Nacken ausstrahlen können. Zusätzlich bestehen Atemnot und Todesangst, Hautblässe, kalter Schweiß und teilweise Übelkeit und Erbrechen (vor allem beim Hinterwandinfarkt). Dieser Zutand kann mehrere Stunden bis Tage andauern.
In circa 20 % der Fälle zeigen die Patienten keine dieser Symptome; man spricht vom "stummen Infarkt". Bei der körperlichen Untersuchung fallen ein 3. und 4. Herzton, Zeichen einer Lungenstauung, ein beschleunigter Puls und Blutdruckveränderungen auf. Zur Sicherung der Diagnose muss ein vollständiges EKG geschrieben werden. Typische akute Infarktzeichen sind dabei pathologische Q-Zacken, R-Reduktion und ST-Hebung; im weiteren Verlauf kommt es zu einer T-Negativierung, die ST-Hebung bleibt bestehen. (Abb. 12)
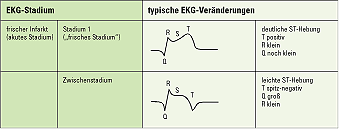
Weitere diagnostische Hinweise sind die erhöhten Blutwerte der herzspezifischen Enzyme (CPK, CMB, GOT).
Komplikationen eines akuten Infarkts stellen Herzrhythmusstörungen, Myokardrupturen, Perikarditis oder Embolien dar.
Die Prognose ist von verschiedenen Faktoren, wie Größe und Lage des Infarkts, Alter des Patienten und Beginn der Behandlung abhängig. Etwa zwei Drittel überleben die ersten vier Wochen nach dem akuten Ereignis, allerdings nur ein Zehntel die nächsten zwanzig Jahre.
Unter dem Begriff der koronaren Herzkrankheit fasst man die subjektiven (Angina pectoris), funktionellen und morphologischen (Narben, Infarkte) Folgen einer Koronarinsuffizienz zusammen.
Ihre bei weitem häufigste Ursache besteht in einer Arteriosklerose der Herzkranzgefäße. Voraussetzung dafür ist eine Schädigung der Gefäßinnenwand, deren Entstehung durch die klassischen Risikofaktoren Hypertonus, Hypercholesterinämie, Diabetes mellitus und Nikotin gefördert wird.
Die häufigste Form der Koronarinsuffizienz ist die Angina pectoris. Der Name leitet sich vom laleinischen angere = zusammendrücken, ängstigen und pectus = Brust ab, und beschreibt somit schon die wichtigsten Symptome:
- Herzschmerzen, die meist um das Brustbein lokalisiert sind und sich von dort in die Halsgegend oder einen Arm ausbreiten können
- Gefühl einer bandartigen Einschnürung, Enge und Schwere im Brustkorb
- Beklemmungsgefühl, das sich bis zur Todesangst steigern kann Häufig wird die Angina pectoris durch Anstrengungen wie Treppensteigen, schnelles Laufen, Heben von schweren Gegenständen oder übermäßige sportliche Aktivität, aber auch durch emotionalen Stress oder externe Einflüsse (Kälte) hervorgerufen.
Direkt resultiert sie aus einer unzureichenden Blutversorgung des Herzmuskels, ist also kein Defekt als solcher, sondern ein Symptom, das zum Beispiel als Warnsignal für eine fortschreitende Arteriosklerose angesehen werden muss.
Ist die Lichtung eines Koronararterienstammes stenosiert, ist normalerweise in Ruhe, bei leichter körperlicher Belastung und normalem Blutdruck die Koronarreserve ausreichend. Bei starker Anstrengung und/oder plötzlichem Blutdruckabfall kommt es akut (= relative, akute Koronarinsuffizienz = stabile Angina pectoris) zu einer Ischämie, weil die Reserve durch die Stenose eingeschränkt ist. In Folge der Ischämie werden zunehmend saure Stoffwechselschlacken und biogene Amine freigesetzt, die den Schmerzanfall auslösen. Durch den Schmerz gewarnt, schränkt der Patient in der Regel die körperliche Tätigkeit ein. Sobald das Blutangebot wieder ausreicht, bildet sich die akute Hypoxidose zurück, die Schlacken werden weggespült und der Schmerz verschwindet.
Diese Anfälle klingen meist ohne Veränderung der Herzstruktur ab oder gehen lediglich mit reversiblen Schäden (Ödem, Schwellung der Fasern) einher.
Etwas anders verhält es sich mit der instabilen Angina pectoris, dem sogenannten Ischämiesyndrom. Sie tritt spontan ohne Belastung auf und zeichnet sich durch eine Zunahme von Anfallshäufigkeit, -intensität und -dauer (Crescendo-Angina) aus und entsteht durch partiellen oder kompletten Koronarverschluss (Tromben). Im Verlauf besonders heftiger und lang dauernder Anfälle entstehen kleine, meist an der Innenschicht des linken Ventrikels gelegene Nekrosen (sog. Innenschichtinfarkte), aus denen sich Herzmuskelschwielen bilden. Zusammen mit der Stenosierung verursachen diese Schwielen eine Dilatation der linken Kammer, die mit fortschreitender Herzinsuffizienz einhergeht und zum Tode führen kann.
Literaturnachweis:
- Roche Lexikon Medizin; 4. neubearbeitete und erweiterte Auflage Urban und Schwarzenberg, München, Wien, Baltimore 1998
- Riecker, G (Hrsg.); Klinische Kardiologie; 3. Auflage Springer Verlag, Berlin, Heidelberg, New York; 1991
- Klepzig, H.; Klepzig, H.; Herzkrankheiten; 6. völlig neubearbeitete Auflage, Thieme Verlag, Stuttgart, New York, 1992
- Lippert, H.; Lehrbuch der Anatomie Urban und Schwarzenberg, München, Wien, Baltimore, 1982
- Stevens, A.; Lowe, J.; Pathologie; Dt. Ausg. hrsg. von Wolfgang Schneider Ullstein Mosby; Berlin, Wiesbaden; 1997
- Thomas, C.; Herz und Gefäße; Schattauer Verlag, Stuttgart, New York, 1989
Bildnachweis:
- Abbildungen 1-6; 9,10 und 11 aus: Thomas C., Herz und Gefäße; Schattauer Verlag, Stuttgart, New York, 1989
- Abbildungen 7 und 8 aus: Sandritter, W.; Thomas, C.; Histopathologie, 8. Auflage Schattauer Verlag, Stuttgart, New York, 1981
- Abbildung 12 aus Roche, Lexikon Medizin, 4. neubearbeitete und erweiterte Auflage Urban und Schwarzenberg, München, Wien, Baltimore, 1998
Anschrift des Verfassers:
Susanne Krell
Burgkmaierstr. 56
80686 München